پنومونی بیمارستانی شایعترین و جدیترین عفونت بیمارستانی است که ۴۰٪ از آن را پنومونی مرتبط با ونتیلاتور (VAP) تشکیل میدهد. VAP ناشی از پاتوژنهای مقاوم به درمان هنوز یک مشکل بالینی دشوار است. سالهاست که دستورالعملها طیف وسیعی از مداخلات (مانند آرامبخشی هدفمند، بالا بردن سر) را برای پیشگیری از VAP توصیه کردهاند، اما VAP در حداکثر ۴۰٪ از بیماران دارای لولهگذاری تراشه رخ میدهد که منجر به طولانیتر شدن مدت بستری در بیمارستان، افزایش استفاده از آنتیبیوتیکها و مرگ میشود. مردم همیشه به دنبال اقدامات پیشگیرانه مؤثرتر هستند.
پنومونی مرتبط با ونتیلاتور (VAP) نوعی پنومونی جدید است که 48 ساعت پس از لولهگذاری تراشه ایجاد میشود و شایعترین و کشندهترین عفونت بیمارستانی در بخش مراقبتهای ویژه (ICU) است. دستورالعملهای انجمن بیماریهای عفونی آمریکا در سال 2016، VAP را از تعریف پنومونی اکتسابی از بیمارستان (HAP) متمایز کرده است (HAP فقط به پنومونی اشاره دارد که پس از بستری شدن در بیمارستان بدون لوله تراشه رخ میدهد و به تهویه مکانیکی مربوط نیست؛ VAP پنومونی پس از لولهگذاری تراشه و تهویه مکانیکی است) و انجمن اروپا و چین معتقدند که VAP هنوز نوع خاصی از HAP است [1-3].
در بیمارانی که تهویه مکانیکی دریافت میکنند، میزان بروز VAP از 9٪ تا 27٪ متغیر است، میزان مرگ و میر 13٪ تخمین زده میشود و میتواند منجر به افزایش مصرف آنتیبیوتیک سیستمیک، تهویه مکانیکی طولانی مدت، اقامت طولانی مدت در بخش مراقبتهای ویژه و افزایش هزینهها شود [4-6]. HAP/VAP در بیماران غیر نقص ایمنی معمولاً ناشی از عفونت باکتریایی است و توزیع پاتوژنهای رایج و ویژگیهای مقاومت آنها با توجه به منطقه، کلاس بیمارستان، جمعیت بیمار و قرار گرفتن در معرض آنتیبیوتیک متفاوت است و با گذشت زمان تغییر میکند. سودوموناس آئروژینوزا پاتوژنهای مرتبط با VAP را در اروپا و آمریکا تحت سلطه خود قرار داد، در حالی که آسینتوباکتر بومانی بیشتری در بیمارستانهای سطح سوم چین جدا شد. یک سوم تا نیمی از کل مرگ و میرهای مرتبط با VAP مستقیماً ناشی از عفونت است و میزان مرگ و میر موارد ناشی از سودوموناس آئروژینوزا و آسینتوباکتر بیشتر است [7،8].
با توجه به ناهمگونی شدید VAP، ویژگی تشخیصی تظاهرات بالینی، تصویربرداری و آزمایشهای آزمایشگاهی آن کم است و دامنه تشخیص افتراقی گسترده است که تشخیص به موقع VAP را دشوار میکند. در عین حال، مقاومت باکتریایی چالش جدی برای درمان VAP ایجاد میکند. تخمین زده میشود که خطر ابتلا به VAP در 5 روز اول استفاده از تهویه مکانیکی 3٪ در روز، بین 5 تا 10 روز 2٪ در روز و برای بقیه مدت 1٪ در روز است. اوج بروز معمولاً پس از 7 روز تهویه رخ میدهد، بنابراین دریچهای وجود دارد که در آن میتوان از عفونت زودهنگام جلوگیری کرد [9،10]. مطالعات زیادی به پیشگیری از VAP پرداختهاند، اما با وجود دههها تحقیق و تلاش برای پیشگیری از VAP (مانند اجتناب از لولهگذاری، جلوگیری از لولهگذاری مجدد، کاهش آرامبخشی، بالا بردن سر تخت به میزان 30 تا 45 درجه و مراقبت از دهان)، به نظر نمیرسد که میزان بروز آن کاهش یافته باشد و بار پزشکی مرتبط با آن همچنان بسیار بالا است.
آنتیبیوتیکهای استنشاقی از دهه 1940 برای درمان عفونتهای مزمن راه هوایی استفاده شدهاند. از آنجا که میتوانند رساندن داروها به محل هدف عفونت (یعنی راه هوایی) را به حداکثر برسانند و عوارض جانبی سیستمیک را کاهش دهند، ارزش کاربردی خوبی در انواع بیماریها نشان دادهاند. آنتیبیوتیکهای استنشاقی اکنون توسط سازمان غذا و داروی ایالات متحده (FDA) و آژانس دارویی اروپا (EMA) برای استفاده در فیبروز کیستیک تأیید شدهاند. آنتیبیوتیکهای استنشاقی میتوانند بار باکتریایی و فراوانی تشدید بیماری در برونشکتازی را بدون افزایش عوارض جانبی کلی به طور قابل توجهی کاهش دهند و دستورالعملهای فعلی آنها را به عنوان درمان خط اول برای بیماران مبتلا به عفونت سودوموناس آئروژینوزا و تشدیدهای مکرر بیماری به رسمیت شناختهاند. آنتیبیوتیکهای استنشاقی در طول دوره قبل از عمل پیوند ریه نیز میتوانند به عنوان داروهای کمکی یا پیشگیرانه استفاده شوند [11،12]. اما در دستورالعملهای VAP ایالات متحده در سال 2016، متخصصان به دلیل عدم وجود کارآزماییهای تصادفی کنترلشده بزرگ، به اثربخشی آنتیبیوتیکهای استنشاقی کمکی اعتماد نداشتند. آزمایش فاز ۳ (INHALE) که در سال ۲۰۲۰ منتشر شد نیز نتوانست نتایج مثبتی به دست آورد (آنتیبیوتیکهای داخل وریدی استنشاقی با کمک آمیکاسین برای عفونت باکتریایی گرم منفی ناشی از بیماران VAP، یک آزمایش دوسوکور، تصادفی، کنترلشده با دارونما، فاز ۳ اثربخشی، در مجموع ۸۰۷ بیمار، داروی سیستمیک + استنشاق کمکی آمیکاسین به مدت ۱۰ روز).
در این زمینه، تیمی به رهبری محققان مرکز بیمارستان منطقهای دانشگاه تور (CHRU) در فرانسه، استراتژی تحقیقاتی متفاوتی را اتخاذ کرد و یک کارآزمایی بالینی تصادفی کنترلشده، چند مرکزی، دوسوکور و چند مرکزی (AMIKINHAL) به ابتکار محقق انجام داد. آمیکاسین استنشاقی یا دارونما برای پیشگیری از VAP در 19 بخش مراقبتهای ویژه در فرانسه مقایسه شدند [13].
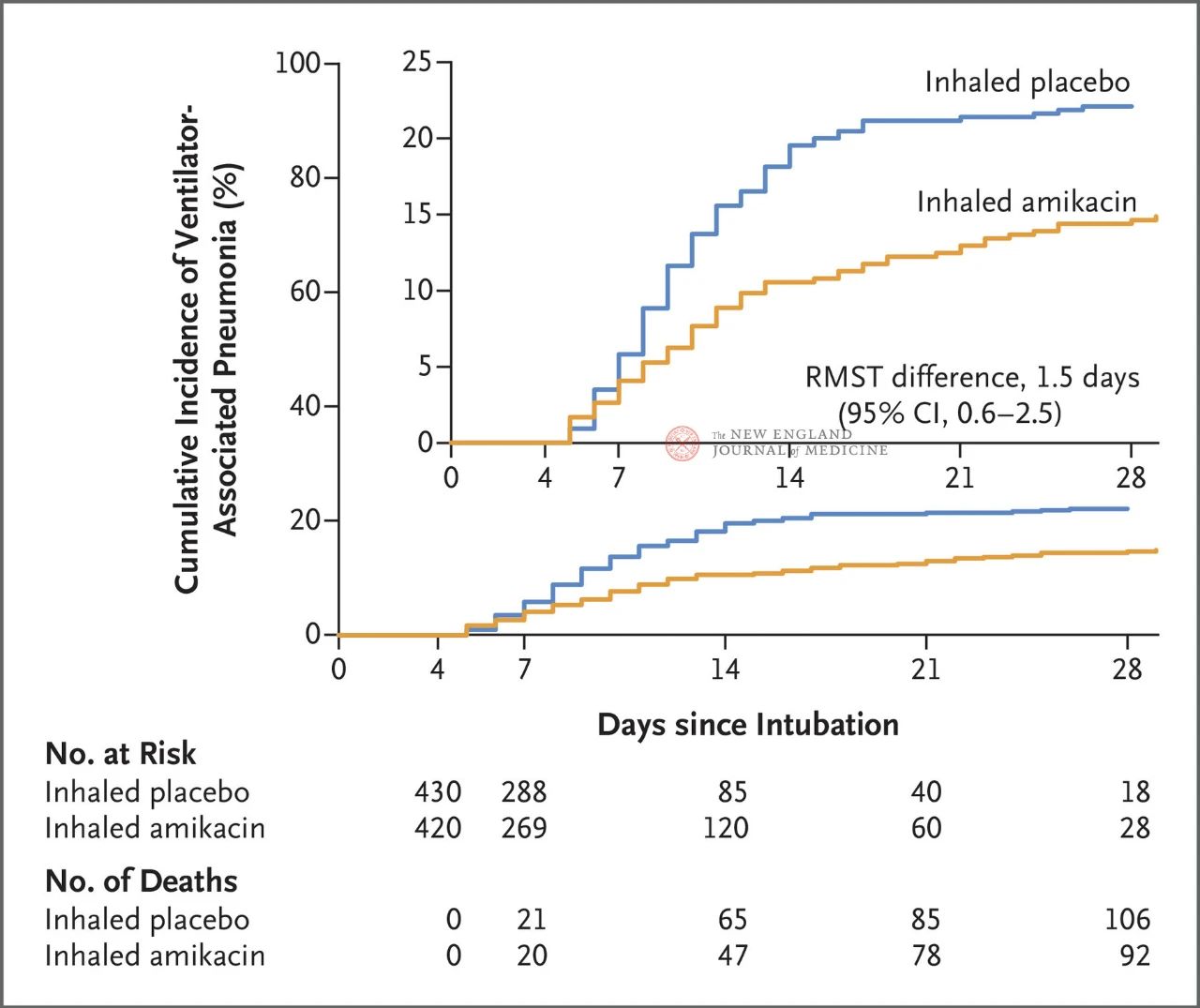
در مجموع ۸۴۷ بیمار بزرگسال که بین ۷۲ تا ۹۶ ساعت تحت تهویه مکانیکی تهاجمی بودند، به طور تصادفی با نسبت ۱ به ۱ به دو گروه تقسیم شدند: استنشاق آمیکاسین (۴۱۷ نفر، ۲۰ میلیگرم بر کیلوگرم وزن ایدهآل بدن، QD) یا استنشاق دارونما (۴۳۰ نفر، ۰.۹٪ معادل کلرید سدیم) به مدت ۳ روز. نقطه پایانی اولیه، اولین دوره VAP از ابتدای تخصیص تصادفی تا روز ۲۸ بود.
نتایج آزمایش نشان داد که در ۲۸ روز، ۶۲ بیمار (۱۵٪) در گروه آمیکاسین و ۹۵ بیمار (۲۲٪) در گروه دارونما به VAP مبتلا شدند (میانگین اختلاف بقا محدود برای VAP 1.5 روز بود؛ ۹۵٪ CI، ۰.۶ تا ۲.۵؛ P=0.004).
از نظر ایمنی، هفت بیمار (1.7٪) در گروه آمیکاسین و چهار بیمار (0.9٪) در گروه دارونما عوارض جانبی جدی مرتبط با آزمایش را تجربه کردند. در میان کسانی که در زمان تصادفیسازی آسیب حاد کلیه نداشتند، 11 بیمار (4٪) در گروه آمیکاسین و 24 بیمار (8٪) در گروه دارونما در روز 28 دچار آسیب حاد کلیه شدند (HR، 0.47؛ 95٪ CI، 0.23~0.96).
این کارآزمایی بالینی سه نکته برجسته داشت. اول، از نظر طراحی مطالعه، کارآزمایی AMIKINHAL از کارآزمایی IASIS (یک کارآزمایی تصادفی، دوسوکور، کنترلشده با دارونما و فاز 2 موازی با 143 بیمار) الهام گرفته است. برای ارزیابی ایمنی و اثربخشی درمان سیستمیک استنشاقی آمیکاسین - فسفومایسین برای عفونت باکتریایی گرم منفی ناشی از VAP) و کارآزمایی INHALE برای پایان دادن به نتایج منفی، درسهای آموختهشده، که بر پیشگیری از VAP تمرکز دارند و نتایج نسبتاً خوبی به دست آوردهاند. با توجه به ویژگیهای مرگ و میر بالا و مدت طولانی بستری در بیمارستان در بیماران مبتلا به تهویه مکانیکی و VAP، اگر استنشاق آمیکاسین بتواند نتایج بسیار متفاوتی در کاهش مرگ و میر و مدت بستری در بیمارستان در این بیماران به دست آورد، برای عملکرد بالینی ارزشمندتر خواهد بود. با این حال، با توجه به ناهمگونی درمان و مراقبت دیرهنگام در هر بیمار و هر مرکز، تعدادی از عوامل مخدوشکننده وجود دارد که میتوانند در مطالعه تداخل ایجاد کنند، بنابراین ممکن است به دست آوردن نتیجه مثبت ناشی از آنتیبیوتیکهای استنشاقی نیز دشوار باشد. بنابراین، یک مطالعه بالینی موفق نه تنها نیازمند طراحی عالی مطالعه، بلکه انتخاب نقاط پایانی اولیه مناسب نیز میباشد.
دوم، اگرچه آنتیبیوتیکهای آمینوگلیکوزیدی به عنوان یک داروی واحد در دستورالعملهای مختلف VAP توصیه نمیشوند، اما آنتیبیوتیکهای آمینوگلیکوزیدی میتوانند پاتوژنهای رایج در بیماران VAP (از جمله سودوموناس آئروژینوزا، آسینتوباکتر و غیره) را پوشش دهند و به دلیل جذب محدود آنها در سلولهای اپیتلیال ریه، غلظت بالا در محل عفونت و سمیت سیستمیک پایین، در بین آنتیبیوتیکهای استنشاقی محبوبیت زیادی دارند. این مقاله با تخمین جامع اندازه اثر تجویز داخل تراشهای جنتامایسین در نمونههای کوچک که قبلاً منتشر شده است، مطابقت دارد، که به طور مشترک اثر آنتیبیوتیکهای آمینوگلیکوزیدی استنشاقی را در پیشگیری از VAP نشان میدهد. همچنین باید توجه داشت که بیشتر گروههای کنترل دارونما که در کارآزماییهای مربوط به آنتیبیوتیکهای استنشاقی انتخاب شدهاند، نرمال سالین هستند. با این حال، با توجه به اینکه استنشاق اتمی نرمال سالین به خودی خود میتواند نقش خاصی در رقیق کردن خلط و کمک به خلطآوری داشته باشد، نرمال سالین ممکن است باعث تداخل خاصی در تجزیه و تحلیل نتایج مطالعه شود که باید به طور جامع در مطالعه در نظر گرفته شود.
علاوه بر این، تطبیق موضعی داروهای HAP/VAP و همچنین پیشگیری با آنتیبیوتیک مهم است. در عین حال، صرف نظر از طول مدت لولهگذاری، اکولوژی بخش مراقبتهای ویژه محلی مهمترین عامل خطر برای عفونت با باکتریهای مقاوم به چند دارو است. بنابراین، درمان تجربی باید تا حد امکان به دادههای میکروبیولوژی بیمارستانهای محلی مراجعه کند و نمیتواند کورکورانه به دستورالعملها یا تجربه بیمارستانهای سطح سوم مراجعه کند. در عین حال، بیماران بدحال که نیاز به تهویه مکانیکی دارند، اغلب با بیماریهای چند سیستمی همراه هستند و تحت تأثیر ترکیبی عوامل متعدد مانند وضعیت استرس، ممکن است پدیده تداخل میکروبهای روده با ریهها نیز وجود داشته باشد. ناهمگونی بالای بیماریهای ناشی از برهمنهی داخلی و خارجی نیز تعیین میکند که ارتقای بالینی در مقیاس بزرگ هر مداخله جدید راه درازی در پیش دارد.
زمان ارسال: دسامبر-02-2023