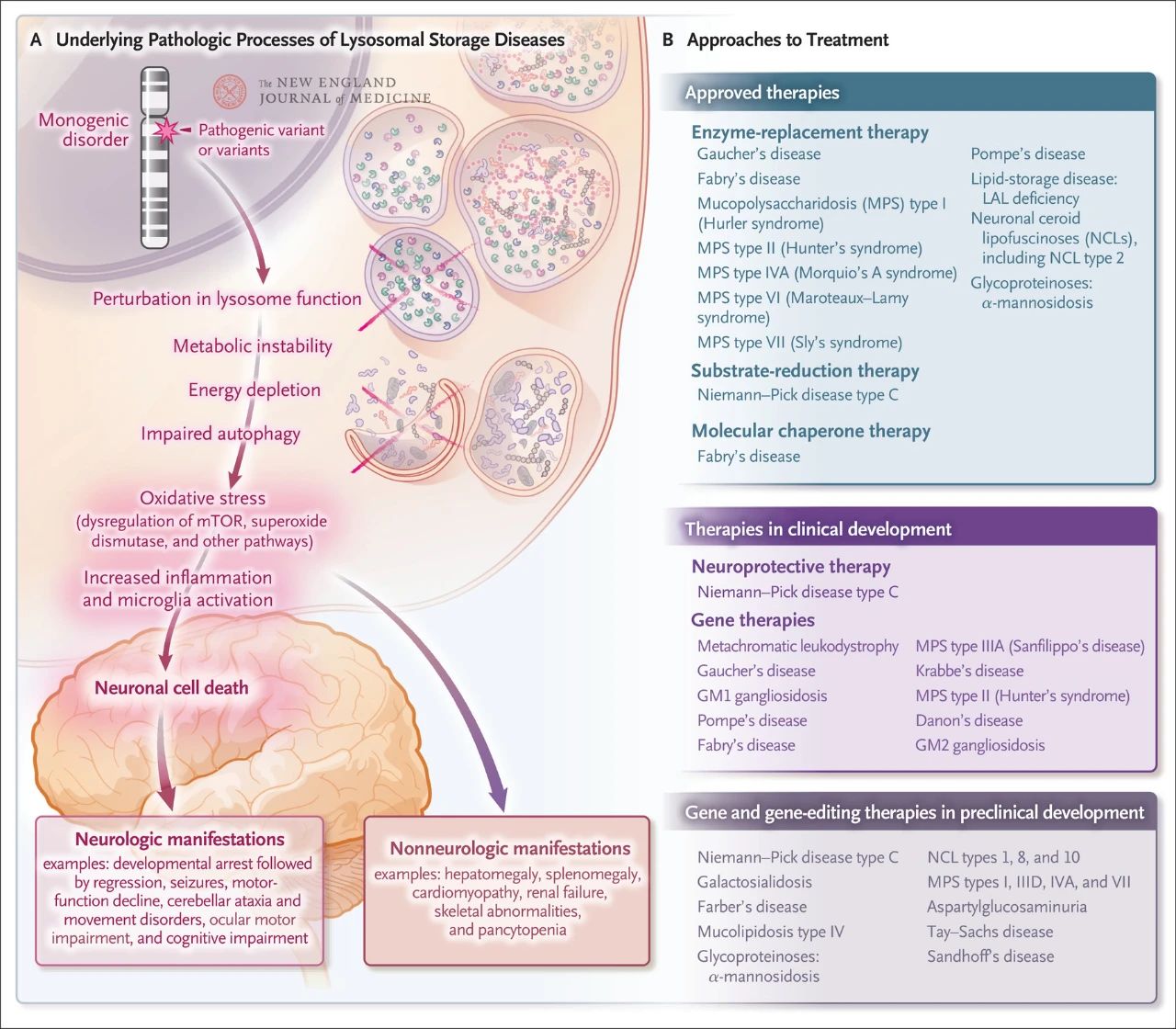
اگرچه نسبتاً نادر است، اما میزان کلی بروز ذخیره لیزوزومی حدود ۱ در هر ۵۰۰۰ تولد زنده است. علاوه بر این، از نزدیک به ۷۰ اختلال ذخیره لیزوزومی شناخته شده، ۷۰٪ بر سیستم عصبی مرکزی تأثیر میگذارند. این اختلالات تک ژنی باعث اختلال در عملکرد لیزوزوم میشوند که منجر به بیثباتی متابولیک، اختلال در تنظیم پروتئین هدف پستانداران راپامایسین (mTOR، که معمولاً التهاب را مهار میکند)، اختلال در اتوفاژی و مرگ سلولهای عصبی میشود. چندین روش درمانی که مکانیسمهای پاتولوژیک زمینهای بیماری ذخیره لیزوزومی را هدف قرار میدهند، تأیید شده یا در حال توسعه هستند، از جمله درمان جایگزینی آنزیم، درمان کاهش سوبسترا، درمان با چاپرون مولکولی، ژن درمانی، ویرایش ژن و درمان محافظت عصبی.
بیماری نیمن پیک نوع C یک اختلال انتقال کلسترول سلولی ذخیرهای لیزوزومی است که در اثر جهشهای دو آللی در NPC1 (95٪) یا NPC2 (5٪) ایجاد میشود. علائم نوع C بیماری نیمن پیک شامل زوال عصبی سریع و کشنده در نوزادی است، در حالی که اشکال دیررس نوجوانی، جوانی و بزرگسالی شامل اسپلنومگالی، فلج نگاه فوق هستهای و آتاکسی مخچهای، اختلال در بیان و زوال عقل پیشرونده است.
در این شماره از مجله، برمووا-ارتل و همکارانش نتایج یک کارآزمایی متقاطع دوسوکور، کنترلشده با دارونما را گزارش میدهند. در این کارآزمایی از یک عامل محافظتکننده عصبی بالقوه، آنالوگ اسید آمینه N-استیل-L-لوسین (NALL)، برای درمان بیماری نیمن-پیک نوع C استفاده شد. آنها 60 بیمار نوجوان و بزرگسال علامتدار را بررسی کردند و نتایج بهبود قابل توجهی را در نمره کل (نقطه پایانی اولیه) مقیاس ارزیابی و رتبهبندی آتاکسی نشان داد.
به نظر میرسد آزمایشهای بالینی N-acetyl-DL-leucine (Tanganil)، که ترکیبی راسمیک از NALL و n-acetyl-D-leucine است، تا حد زیادی مبتنی بر تجربه باشد: مکانیسم اثر آن به روشنی مشخص نشده است. N-acetyl-dl-leucine از دهه 1950 برای درمان سرگیجه حاد تأیید شده است. مدلهای حیوانی نشان میدهند که این دارو با متعادل کردن بیشقطبیسازی و دپلاریزاسیون نورونهای دهلیزی میانی عمل میکند. متعاقباً، Strupp و همکارانش نتایج یک مطالعه کوتاهمدت را گزارش کردند که در آن بهبود علائم را در 13 بیمار مبتلا به آتاکسی مخچهای دژنراتیو با علل مختلف مشاهده کردند، یافتههایی که علاقه به بررسی مجدد این دارو را دوباره برانگیخت.
مکانیسمی که n-acetyl-DL-leucine از طریق آن عملکرد عصب را بهبود میبخشد هنوز مشخص نیست، اما یافتهها در دو مدل موش، یکی از بیماری نیمن-پیک نوع C و دیگری از اختلال ذخیره گانگلیوزید GM2 نوع O (بیماری ساندهوف)، یکی دیگر از بیماریهای لیزوزومی نورودژنراتیو، توجه را به NALL معطوف کرده است. به طور خاص، بقای موشهای Npc1-/- که با n-acetyl-DL-leucine یا NALL (L-enantiomers) درمان شدند، بهبود یافت، در حالی که بقای موشهای درمان شده با n-acetyl-D-leucine (D-enantiomers) بهبود نیافت، که نشان میدهد NALL شکل فعال دارو است. در یک مطالعه مشابه از اختلال ذخیره گانگلیوزید GM2 نوع O (Hexb-/-)، n-acetyl-DL-leucine منجر به افزایش متوسط اما قابل توجه طول عمر در موشها شد.
برای بررسی مکانیسم عمل n-acetyl-DL-leucine، محققان مسیر متابولیکی لوسین را با اندازهگیری متابولیتها در بافتهای مخچه حیوانات جهشیافته بررسی کردند. در مدل O نوع اختلال ذخیرهسازی گانگلیوزید GM2، n-acetyl-DL-leucine متابولیسم گلوکز و گلوتامات را عادی میکند، اتوفاژی را افزایش میدهد و سطح سوپراکسید دیسموتاز (یک جاذب فعال اکسیژن) را افزایش میدهد. در مدل C بیماری نیمن-پیک، تغییراتی در متابولیسم گلوکز و آنتیاکسیدان و بهبود متابولیسم انرژی میتوکندری مشاهده شد. اگرچه L-leucine یک فعالکننده قوی mTOR است، اما هیچ تغییری در سطح یا فسفوریلاسیون mTOR پس از درمان با n-acetyl-DL-leucine یا انانتیومرهای آن در هر دو مدل موش مشاهده نشد.
اثر محافظت عصبی NALL در مدل موشی آسیب مغزی ناشی از گیرافتادگی قشر مغز مشاهده شده است. این اثرات شامل کاهش نشانگرهای التهابی عصبی، کاهش مرگ سلولهای قشر مغز و بهبود جریان اتوفاژی است. پس از درمان NALL، عملکردهای حرکتی و شناختی موشهای آسیبدیده بازیابی شدند و اندازه ضایعه کاهش یافت.
پاسخ التهابی سیستم عصبی مرکزی، مشخصه اکثر اختلالات ذخیره لیزوزومی نورودژنراتیو است. اگر التهاب عصبی با درمان NALL کاهش یابد، علائم بالینی بسیاری از اختلالات ذخیره لیزوزومی نورودژنراتیو، اگر نگوییم همه آنها، ممکن است بهبود یابد. همانطور که این مطالعه نشان میدهد، انتظار میرود NALL با سایر درمانهای بیماری ذخیره لیزوزومی نیز همافزایی داشته باشد.
بسیاری از اختلالات ذخیرهسازی لیزوزومی نیز با آتاکسی مخچهای مرتبط هستند. طبق یک مطالعه بینالمللی که شامل کودکان و بزرگسالان مبتلا به اختلالات ذخیرهسازی گانگلیوزید GM2 (بیماری تای-ساکس و بیماری سندهوف) بود، آتاکسی پس از درمان NALL کاهش یافت و هماهنگی حرکتی ظریف بهبود یافت. با این حال، یک کارآزمایی بزرگ، چند مرکزی، دوسوکور، تصادفی و کنترلشده با دارونما نشان داد که n-acetyl-DL-leucine در بیماران مبتلا به آتاکسی مخچهای مختلط (ارثی، غیرارثی و غیرقابل توضیح) از نظر بالینی مؤثر نبود. این یافته نشان میدهد که اثربخشی ممکن است فقط در کارآزماییهایی که شامل بیماران مبتلا به آتاکسی مخچهای ارثی و مکانیسمهای عمل مرتبط با آن تجزیه و تحلیل شدهاند، مشاهده شود. علاوه بر این، از آنجا که NALL التهاب عصبی را کاهش میدهد، که میتواند منجر به آسیب تروماتیک مغزی شود، ممکن است کارآزماییهای NALL برای درمان آسیب تروماتیک مغزی در نظر گرفته شود.
زمان ارسال: مارس-02-2024