پیوند ریه درمان پذیرفتهشده برای بیماریهای پیشرفته ریه است. در چند دهه گذشته، پیوند ریه پیشرفتهای چشمگیری در غربالگری و ارزیابی گیرندگان پیوند، انتخاب، حفظ و تخصیص ریههای اهداکننده، تکنیکهای جراحی، مدیریت پس از عمل، مدیریت عوارض و سرکوب سیستم ایمنی داشته است.
در بیش از 60 سال، پیوند ریه از یک درمان تجربی به درمان استاندارد پذیرفته شده برای بیماریهای ریوی تهدیدکننده زندگی تبدیل شده است. علیرغم مشکلات رایجی مانند اختلال عملکرد اولیه پیوند، اختلال عملکرد مزمن ریه پیوندی (CLAD)، افزایش خطر عفونتهای فرصتطلب، سرطان و مشکلات مزمن سلامتی مرتبط با سرکوب سیستم ایمنی، امیدی برای بهبود بقای بیمار و کیفیت زندگی از طریق انتخاب گیرنده مناسب وجود دارد. در حالی که پیوند ریه در سراسر جهان رایجتر میشود، تعداد عملهای جراحی هنوز با تقاضای رو به رشد همگام نیست. این بررسی بر وضعیت فعلی و پیشرفتهای اخیر در پیوند ریه و همچنین فرصتهای آینده برای اجرای مؤثر این درمان چالشبرانگیز اما بالقوه تغییر دهنده زندگی تمرکز دارد.
ارزیابی و انتخاب گیرندگان بالقوه
از آنجا که ریههای اهداکننده مناسب نسبتاً کمیاب هستند، مراکز پیوند از نظر اخلاقی موظفند اندامهای اهدایی را به گیرندگان بالقوهای اختصاص دهند که بیشترین احتمال را برای بهرهمندی از پیوند دارند. تعریف سنتی از چنین گیرندگان بالقوهای این است که آنها با فرض اینکه ریههای پیوند شده کاملاً عملکردی باشند، بیش از 50٪ خطر مرگ ناشی از بیماری ریوی در عرض 2 سال و بیش از 80٪ احتمال زنده ماندن 5 سال پس از پیوند را دارند. شایعترین اندیکاسیونهای پیوند ریه، فیبروز ریوی، بیماری انسدادی مزمن ریوی، بیماری عروق ریوی و فیبروز کیستیک هستند. بیماران بر اساس کاهش عملکرد ریه، کاهش عملکرد فیزیکی و پیشرفت بیماری علیرغم استفاده حداکثری از دارو و درمانهای جراحی ارجاع داده میشوند. سایر معیارهای خاص بیماری نیز در نظر گرفته میشوند. چالشهای پیشآگهی از استراتژیهای ارجاع زودهنگام پشتیبانی میکنند که امکان مشاوره بهتر در مورد ریسک-فایده را برای بهبود تصمیمگیری مشترک آگاهانه و فرصت تغییر موانع بالقوه برای نتایج موفقیتآمیز پیوند فراهم میکند. این تیم چندرشتهای، نیاز به پیوند ریه و خطر عوارض پس از پیوند بیمار به دلیل استفاده از داروهای سرکوبکننده سیستم ایمنی، مانند خطر عفونتهای بالقوه تهدیدکننده زندگی را ارزیابی خواهد کرد. غربالگری برای اختلال عملکرد اندامهای خارج ریوی، آمادگی جسمانی، سلامت روان، ایمنی سیستمیک و سرطان بسیار مهم است. ارزیابیهای خاص از عروق کرونر و مغزی، عملکرد کلیه، سلامت استخوان، عملکرد مری، ظرفیت روانی-اجتماعی و حمایت اجتماعی بسیار مهم است، در عین حال، برای حفظ شفافیت و جلوگیری از نابرابری در تعیین مناسب بودن برای پیوند، دقت لازم صورت میگیرد.
عوامل خطر چندگانه مضرتر از عوامل خطر منفرد هستند. موانع سنتی پیوند شامل سن بالا، چاقی، سابقه سرطان، بیماریهای وخیم و بیماریهای سیستمیک همراه است، اما این عوامل اخیراً به چالش کشیده شدهاند. سن گیرندگان پیوند به طور پیوسته در حال افزایش است و تا سال 2021، 34٪ از گیرندگان پیوند در ایالات متحده بالای 65 سال خواهند بود که نشان دهنده تأکید فزاینده بر سن بیولوژیکی نسبت به سن تقویمی است. اکنون، علاوه بر مسافت پیادهروی شش دقیقهای، اغلب ارزیابی رسمیتری از ضعف و ناتوانی وجود دارد که بر ذخایر بدنی و پاسخهای مورد انتظار به عوامل استرسزا تمرکز دارد. ضعف و ناتوانی پس از پیوند ریه با پیامدهای ضعیف مرتبط است و ضعف و ناتوانی معمولاً با ترکیب بدن مرتبط است. روشهای محاسبه چاقی و ترکیب بدن همچنان در حال تکامل هستند و کمتر بر BMI و بیشتر بر محتوای چربی و توده عضلانی تمرکز میکنند. ابزارهایی که نوید کمیسازی تزلزل، الیگومیوز و تابآوری را میدهند، برای پیشبینی بهتر توانایی بهبودی پس از پیوند ریه در حال توسعه هستند. با توانبخشی ریه قبل از عمل، میتوان ترکیب بدن و ناتوانی را اصلاح کرد و در نتیجه نتایج را بهبود بخشید.
در مورد بیماریهای حاد و بحرانی، تعیین میزان ناتوانی و توانایی بهبودی به ویژه چالش برانگیز است. پیوند اعضا در بیمارانی که تهویه مکانیکی دریافت میکنند، قبلاً نادر بود، اما اکنون رایجتر شده است. علاوه بر این، استفاده از حمایت حیاتی خارج از بدن به عنوان یک درمان انتقالی قبل از پیوند در سالهای اخیر افزایش یافته است. پیشرفت در فناوری و دسترسی عروقی، این امکان را برای بیماران هوشیار و با دقت انتخاب شده که تحت حمایت حیاتی خارج از بدن قرار میگیرند، فراهم کرده است تا در مراحل رضایت آگاهانه و توانبخشی فیزیکی شرکت کنند و پس از پیوند به نتایجی مشابه با بیمارانی که قبل از پیوند به حمایت حیاتی خارج از بدن نیاز نداشتند، دست یابند.
بیماری سیستمیک همزمان قبلاً یک منع مطلق در نظر گرفته میشد، اما اکنون باید تأثیر آن بر پیامدهای پس از پیوند به طور خاص ارزیابی شود. با توجه به اینکه سرکوب سیستم ایمنی مرتبط با پیوند، احتمال عود سرطان را افزایش میدهد، دستورالعملهای قبلی در مورد بدخیمیهای از پیش موجود، بر این الزام تأکید داشتند که بیماران قبل از قرار گرفتن در لیست انتظار پیوند، پنج سال عاری از سرطان باشند. با این حال، با مؤثرتر شدن درمانهای سرطان، اکنون توصیه میشود احتمال عود سرطان بر اساس هر بیمار ارزیابی شود. بیماری خودایمنی سیستمیک به طور سنتی منع مصرف در نظر گرفته شده است، دیدگاهی که مشکلساز است زیرا بیماری پیشرفته ریه تمایل به محدود کردن امید به زندگی چنین بیمارانی دارد. دستورالعملهای جدید توصیه میکنند که قبل از پیوند ریه، ارزیابی و درمان هدفمندتر بیماری انجام شود تا تظاهرات بیماری که ممکن است بر پیامدها تأثیر منفی بگذارد، مانند مشکلات مری مرتبط با اسکلرودرمی، کاهش یابد.
آنتیبادیهای در گردش علیه زیرکلاسهای خاص HLA میتوانند برخی از گیرندگان بالقوه را به اندامهای اهدایی خاص حساسیت دهند و در نتیجه زمان انتظار طولانیتر، احتمال پیوند کمتر، رد حاد عضو و خطر بالای CLAD را به همراه داشته باشند. با این حال، برخی از پیوندها بین آنتیبادیهای گیرنده کاندید و انواع اهداکنندگان با رژیمهای حساسیتزدایی قبل از عمل، از جمله تعویض پلاسما، ایمونوگلوبولین داخل وریدی و درمان ضد سلول B، به نتایج مشابهی دست یافتهاند.
انتخاب و استفاده از ریه اهدایی
اهدای عضو یک عمل نوعدوستانه است. اخذ رضایت اهداکننده و احترام به استقلال او مهمترین عوامل اخلاقی هستند. ریههای اهداکننده ممکن است در اثر ضربه به قفسه سینه، احیای قلبی ریوی (CPR)، آسپیراسیون، آمبولی، آسیب یا عفونت مرتبط با دستگاه تنفس مصنوعی یا آسیب عصبی آسیب ببینند، بنابراین بسیاری از ریههای اهداکننده برای پیوند مناسب نیستند. ISHLT (انجمن بینالمللی پیوند قلب و ریه)
پیوند ریه معیارهای عمومی پذیرفتهشده برای اهداکننده را تعریف میکند که از مرکز پیوندی به مرکز پیوند دیگر متفاوت است. در واقع، تعداد بسیار کمی از اهداکنندگان معیارهای «ایدهآل» برای اهدای ریه را دارند (شکل 2). افزایش استفاده از ریههای اهداکنندگان از طریق سهلانگاری معیارهای اهداکننده (یعنی اهداکنندگانی که استانداردهای ایدهآل مرسوم را برآورده نمیکنند)، ارزیابی دقیق، مراقبت فعال از اهداکننده و ارزیابی آزمایشگاهی (شکل 2) حاصل شده است. سابقه سیگار کشیدن فعال توسط اهداکننده یک عامل خطر برای اختلال عملکرد اولیه پیوند در گیرنده است، اما خطر مرگ ناشی از استفاده از چنین اندامهایی محدود است و باید در برابر عواقب مرگ و میر ناشی از انتظار طولانی برای دریافت ریه اهداکننده از یک فرد غیرسیگاری سنجیده شود. استفاده از ریههای اهداکنندگان مسنتر (بالای 70 سال) که با دقت انتخاب شدهاند و هیچ عامل خطر دیگری ندارند، میتواند به نتایج بقا و عملکرد ریه مشابه اهداکنندگان جوانتر منجر شود.
مراقبت مناسب از اهداکنندگان متعدد عضو و بررسی احتمال اهدای ریه برای اطمینان از اینکه ریههای اهداکننده احتمال بالایی برای پیوند دارند، ضروری است. در حالی که تعداد کمی از ریههای ارائه شده در حال حاضر تعریف سنتی از ریه اهداکننده ایدهآل را برآورده میکنند، کاهش معیارها فراتر از این معیارهای سنتی میتواند منجر به استفاده موفقیتآمیز از اندامها بدون به خطر انداختن نتایج شود. روشهای استاندارد حفظ ریه به محافظت از یکپارچگی اندام قبل از کاشت در گیرنده کمک میکند. اندامها را میتوان تحت شرایط مختلف، مانند حفظ کرایواستاتیک یا پرفیوژن مکانیکی در هیپوترمی یا دمای طبیعی بدن، به مراکز پیوند منتقل کرد. ریههایی که برای پیوند فوری مناسب در نظر گرفته نمیشوند، ممکن است به صورت عینیتری ارزیابی شوند و ممکن است با پرفیوژن ریه آزمایشگاهی (EVLP) درمان شوند یا برای مدت طولانیتری برای غلبه بر موانع سازمانی پیوند نگهداری شوند. نوع پیوند ریه، روش و پشتیبانی حین عمل، همگی به نیازهای بیمار و تجربه و ترجیحات جراح بستگی دارند. برای گیرندگان بالقوه پیوند ریه که بیماری آنها در حین انتظار برای پیوند به طور چشمگیری بدتر میشود، حمایت از حیات خارج از بدن ممکن است به عنوان یک درمان انتقالی قبل از پیوند در نظر گرفته شود. عوارض زودرس پس از عمل ممکن است شامل خونریزی، انسداد راه هوایی یا آناستوموز عروقی و عفونت زخم باشد. آسیب به عصب فرنیک یا واگ در قفسه سینه میتواند منجر به عوارض دیگری شود که به ترتیب بر عملکرد دیافراگم و تخلیه معده تأثیر میگذارند. ریه اهداکننده ممکن است پس از کاشت و برقراری مجدد جریان خون، دچار آسیب حاد ریوی زودرس، یعنی اختلال عملکرد اولیه پیوند، شود. طبقهبندی و درمان شدت اختلال عملکرد اولیه پیوند که با خطر بالای مرگ زودرس همراه است، معنادار است. از آنجا که آسیب احتمالی ریه اهداکننده در عرض چند ساعت پس از آسیب اولیه مغز رخ میدهد، مدیریت ریه باید شامل تنظیمات تهویه مناسب، انبساط مجدد آلوئولی، برونکوسکوپی و آسپیراسیون و لاواژ (برای نمونهبرداری از کشتها)، مدیریت مایعات بیمار و تنظیم موقعیت قفسه سینه باشد. ABO مخفف گروههای خونی A، B، AB و O، CVP مخفف فشار ورید مرکزی، DCD مخفف اهداکننده ریه از مرگ قلبی، ECMO مخفف اکسیژنرسانی غشایی خارج از بدن، EVLW مخفف آب ریوی خارج عروقی، PaO2/FiO2 مخفف نسبت فشار جزئی اکسیژن شریانی به غلظت اکسیژن استنشاقی و PEEP مخفف فشار مثبت انتهای بازدمی است. PiCCO نشان دهنده برون ده قلبی شکل موج شاخص نبض است.
در برخی کشورها، استفاده از ریه اهداکننده کنترلشده (DCD) در بیماران مبتلا به مرگ قلبی به 30 تا 40 درصد افزایش یافته است و میزان مشابهی از رد حاد عضو، CLAD و بقا حاصل شده است. به طور سنتی، باید از پیوند اعضای اهداکنندگان آلوده به ویروس عفونی به گیرندگان غیرآلوده خودداری شود. با این حال، در سالهای اخیر، داروهای ضد ویروسی که مستقیماً علیه ویروس هپاتیت C (HCV) عمل میکنند، امکان پیوند ایمن ریههای اهداکننده HCV مثبت را به گیرندگان HCV منفی فراهم کردهاند. به طور مشابه، ریههای اهداکننده مبتلا به ویروس نقص ایمنی انسانی (HIV) را میتوان به گیرندگان HIV مثبت پیوند زد و ریههای اهداکننده مبتلا به ویروس هپاتیت B (HBV) را میتوان به گیرندگانی که علیه HBV واکسینه شدهاند و کسانی که ایمن هستند پیوند زد. گزارشهایی از پیوند ریه از اهداکنندگان آلوده فعال یا قبلی به SARS-CoV-2 وجود دارد. برای تعیین ایمنی آلوده کردن ریههای اهداکننده با ویروسهای عفونی برای پیوند، به شواهد بیشتری نیاز داریم.
با توجه به پیچیدگی به دست آوردن چندین عضو، ارزیابی کیفیت ریههای اهداکننده چالشبرانگیز است. استفاده از یک سیستم پرفیوژن ریه در شرایط آزمایشگاهی (in vitro) برای ارزیابی، امکان ارزیابی دقیقتر عملکرد ریه اهداکننده و پتانسیل ترمیم آن را قبل از استفاده فراهم میکند (شکل 2). از آنجایی که ریه اهداکننده بسیار مستعد آسیب است، سیستم پرفیوژن ریه در شرایط آزمایشگاهی (in vitro) بستری را برای تجویز درمانهای بیولوژیکی خاص برای ترمیم ریه اهداکننده آسیبدیده فراهم میکند (شکل 2). دو کارآزمایی تصادفی نشان دادهاند که پرفیوژن ریه در شرایط آزمایشگاهی (in vitro) در دمای طبیعی بدن از ریههای اهداکننده که معیارهای مرسوم را برآورده میکنند، ایمن است و تیم پیوند میتواند از این طریق زمان نگهداری را افزایش دهد. گزارش شده است که نگهداری ریههای اهداکننده در دمای بالاتر (6 تا 10 درجه سانتیگراد) به جای دمای 0 تا 4 درجه سانتیگراد روی یخ، سلامت میتوکندری را بهبود میبخشد، آسیب را کاهش میدهد و عملکرد ریه را بهبود میبخشد. برای پیوندهای نیمهانتخابی روزانه، گزارش شده است که نگهداری طولانیتر در طول شب، نتایج خوبی پس از پیوند به همراه دارد. یک کارآزمایی بزرگ با هدف مقایسه ایمنی غیر پایینتر در دمای ۱۰ درجه سانتیگراد با انجماد استاندارد در حال انجام است (شماره ثبت NCT05898776 در ClinicalTrials.gov). مردم به طور فزایندهای از طریق مراکز مراقبت از اهداکنندگان چند عضوی، بازیابی به موقع عضو را ترویج میکنند و از طریق مراکز ترمیم عضو، عملکرد عضو را بهبود میبخشند تا بتوان از اندامهای با کیفیت بهتر برای پیوند استفاده کرد. تأثیر این تغییرات در اکوسیستم پیوند هنوز در حال ارزیابی است.
به منظور حفظ اندامهای DCD قابل کنترل، میتوان از پرفیوژن موضعی با دمای طبیعی بدن در محل از طریق اکسیژناسیون غشایی خارج از بدن (ECMO) برای ارزیابی عملکرد اندامهای شکمی و پشتیبانی از دریافت و حفظ مستقیم اندامهای قفسه سینه، از جمله ریهها، استفاده کرد. تجربه پیوند ریه پس از پرفیوژن موضعی با دمای طبیعی بدن در قفسه سینه و شکم محدود است و نتایج متناقضی دارد. نگرانیهایی وجود دارد که این روش ممکن است به اهداکنندگان متوفی آسیب برساند و اصول اخلاقی اساسی برداشت عضو را نقض کند. بنابراین، پرفیوژن موضعی در دمای طبیعی بدن هنوز در بسیاری از کشورها مجاز نیست.
سرطان
میزان بروز سرطان در جمعیت پس از پیوند ریه بیشتر از جمعیت عمومی است و پیشآگهی آن معمولاً ضعیف است و ۱۷٪ از مرگ و میرها را تشکیل میدهد. سرطان ریه و بیماری لنفوپرولیفراتیو پس از پیوند (PTLD) شایعترین علل مرگ و میر مرتبط با سرطان هستند. سرکوب سیستم ایمنی طولانی مدت، اثرات سیگار کشیدن قبلی یا خطر بیماری زمینهای ریه، همگی منجر به خطر ابتلا به سرطان ریه در ریه خود گیرنده ریه میشوند، اما در موارد نادر، سرطان ریه تحت بالینی منتقل شده از اهداکننده نیز میتواند در ریههای پیوند شده رخ دهد. سرطان پوست غیر ملانوم شایعترین سرطان در بین گیرندگان پیوند است، بنابراین نظارت منظم بر سرطان پوست ضروری است. PTLD سلول B ناشی از ویروس اپشتین بار یکی از علل مهم بیماری و مرگ است. اگرچه PTLD میتواند با حداقل سرکوب سیستم ایمنی برطرف شود، اما معمولاً درمان هدفمند سلول B با ریتوکسیماب، شیمیدرمانی سیستمیک یا هر دو مورد نیاز است.
بقا و پیامدهای بلندمدت
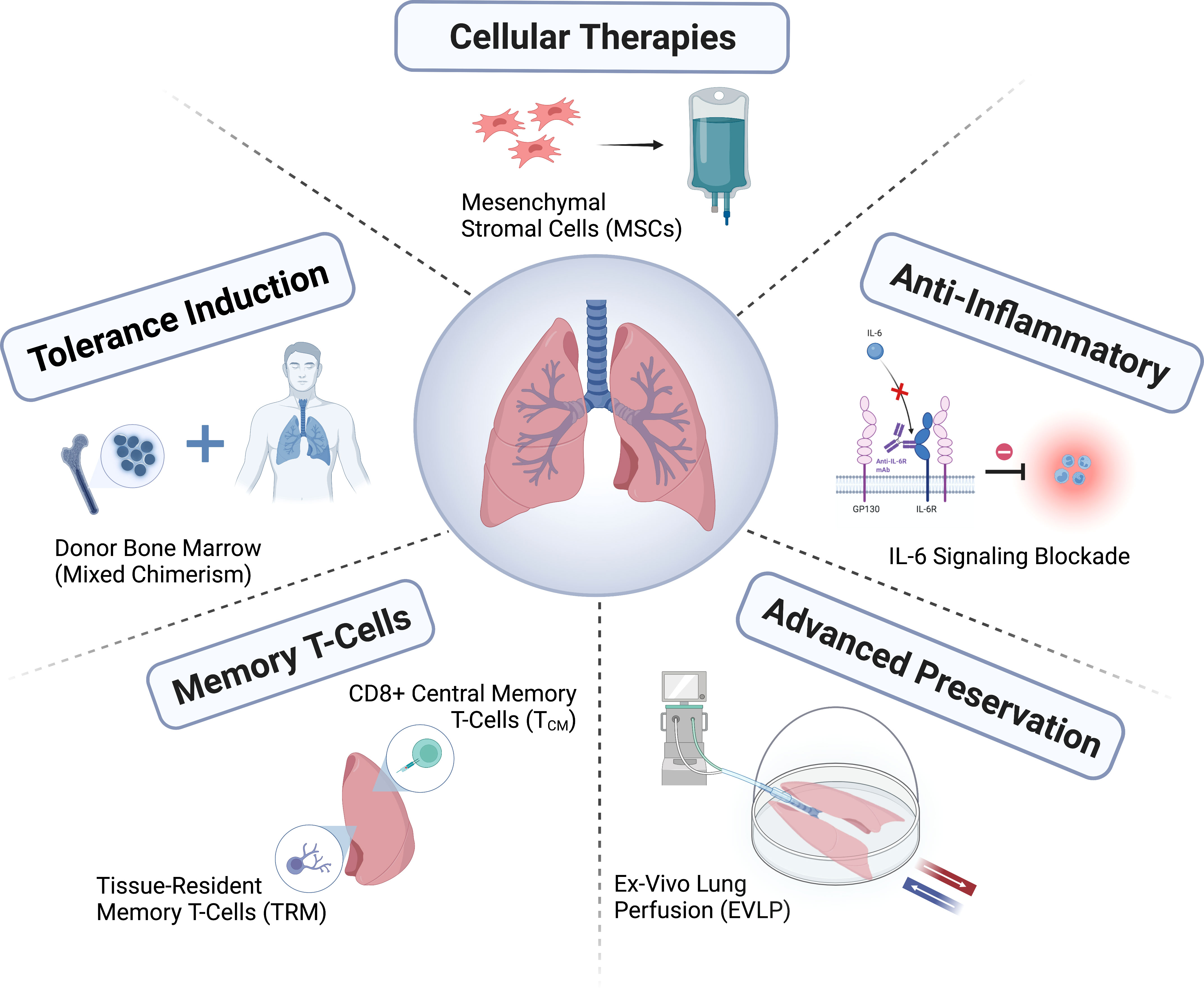
بقای پس از پیوند ریه در مقایسه با سایر پیوندهای عضو، با میانگین 6.7 سال، همچنان محدود است و پیشرفت کمی در نتایج بلندمدت بیمار در طول سه دهه حاصل شده است. با این حال، بسیاری از بیماران بهبود قابل توجهی در کیفیت زندگی، وضعیت جسمی و سایر نتایج گزارش شده توسط بیمار تجربه کردهاند. برای انجام ارزیابی جامعتر از اثرات درمانی پیوند ریه، لازم است به نتایج گزارش شده توسط این بیماران توجه بیشتری شود. یک نیاز بالینی مهم برآورده نشده، پرداختن به مرگ گیرنده در اثر عوارض کشنده نارسایی تأخیری پیوند یا سرکوب طولانی مدت سیستم ایمنی است. برای گیرندگان پیوند ریه، باید مراقبت طولانی مدت فعال ارائه شود که مستلزم کار تیمی برای محافظت از سلامت کلی گیرنده با نظارت و حفظ عملکرد پیوند از یک سو، به حداقل رساندن عوارض جانبی سرکوب سیستم ایمنی و حمایت از سلامت جسمی و روانی گیرنده از سوی دیگر است (شکل 1).
جهتگیری آینده
پیوند ریه درمانی است که در مدت زمان کوتاهی راه درازی را پیموده است، اما هنوز به پتانسیل کامل خود نرسیده است. کمبود ریههای اهداکننده مناسب همچنان یک چالش بزرگ است و روشهای جدیدی برای ارزیابی و مراقبت از اهداکنندگان، درمان و ترمیم ریههای اهداکننده و بهبود حفظ اهداکننده هنوز در حال توسعه است. برای افزایش بیشتر مزایای خالص، لازم است سیاستهای تخصیص عضو با بهبود تطابق بین اهداکنندگان و گیرندگان بهبود یابد. علاقه فزایندهای به تشخیص رد پیوند یا عفونت از طریق تشخیص مولکولی، به ویژه با DNA آزاد مشتق شده از اهداکننده، یا در جهت به حداقل رساندن سرکوب سیستم ایمنی وجود دارد. با این حال، کاربرد این تشخیصها به عنوان کمکی برای روشهای فعلی نظارت بالینی بر پیوند هنوز مشخص نشده است.
حوزه پیوند ریه از طریق تشکیل کنسرسیومها (به عنوان مثال، ClinicalTrials.gov با شماره ثبت NCT04787822؛ https://lungtransplantconsortium.org) توسعه یافته است. این روش برای همکاری، به پیشگیری و درمان اختلال عملکرد اولیه پیوند، پیشبینی CLAD، تشخیص زودهنگام و نقاط داخلی (اندوتایپینگ)، اصلاح سندرم کمک خواهد کرد. پیشرفت سریعتری در مطالعه اختلال عملکرد اولیه پیوند، رد پیوند با واسطه آنتیبادی، مکانیسمهای ALAD و CLAD حاصل شده است. به حداقل رساندن عوارض جانبی و کاهش خطر ALAD و CLAD از طریق درمان سرکوبکننده سیستم ایمنی شخصی، و همچنین تعریف پیامدهای بیمار محور و گنجاندن آنها در معیارهای پیامد، کلید بهبود موفقیت طولانیمدت پیوند ریه خواهد بود.
زمان ارسال: ۲۳ نوامبر ۲۰۲۴