امروزه، بیماری کبد چرب غیرالکلی (NAFLD) به علت اصلی بیماری مزمن کبدی در چین و حتی در جهان تبدیل شده است. طیف این بیماری شامل استئاتوهپاتیت کبدی ساده، استئاتوهپاتیت غیرالکلی (NASH) و سیروز و سرطان کبد مرتبط است. NASH با تجمع بیش از حد چربی در سلولهای کبدی و آسیب و التهاب سلولی ناشی از آن، با یا بدون فیبروز کبدی مشخص میشود. شدت فیبروز کبدی در بیماران NASH ارتباط نزدیکی با پیشآگهی ضعیف کبد (سیروز و عوارض آن و کارسینوم هپاتوسلولار)، حوادث قلبی عروقی، بدخیمیهای خارج کبدی و مرگ به هر علتی دارد. NASH میتواند بر کیفیت زندگی بیماران تأثیر منفی بگذارد. با این حال، هیچ دارو یا درمانی برای درمان NASH تأیید نشده است.
یک مطالعه اخیر (ENLIVEN) که در مجله پزشکی نیوانگلند (NEJM) منتشر شده است، نشان داد که پگوزافرمین هم فیبروز کبدی و هم التهاب کبدی را در بیماران مبتلا به NASH غیر سیروزی که با بیوپسی تأیید شدهاند، بهبود میبخشد.
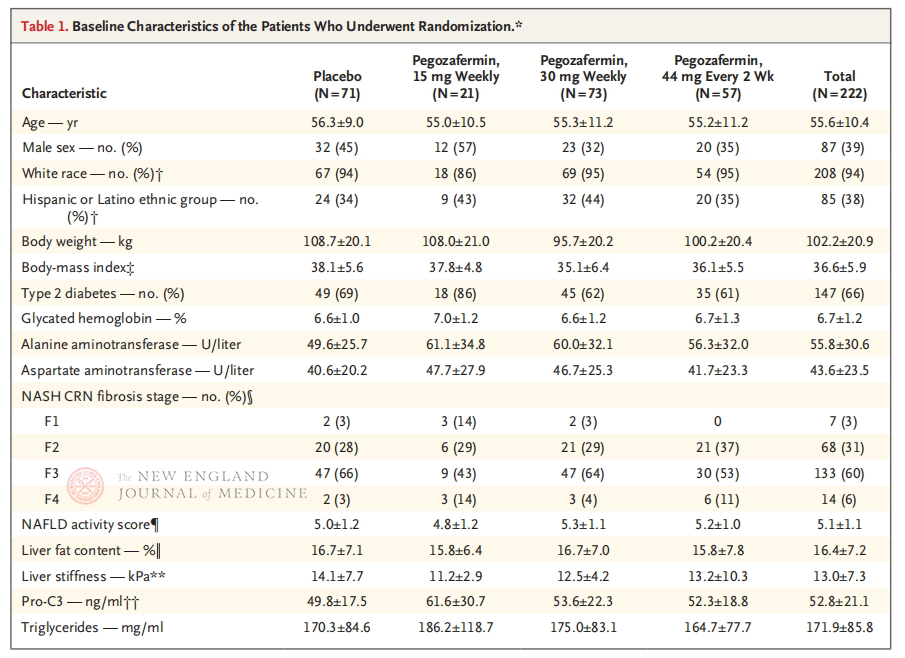
این کارآزمایی بالینی چند مرکزی، تصادفی، دوسوکور و کنترلشده با دارونما، فاز 2b، که توسط پروفسور روهیت لومبا و تیم بالینی او در دانشکده پزشکی دانشگاه کالیفرنیا، سن دیگو انجام شد، 222 بیمار مبتلا به NASH مرحله F2-3 تایید شده با بیوپسی را بین 28 سپتامبر 2021 و 15 آگوست 2022 ثبت نام کرد. آنها به طور تصادفی به دو گروه پگوزافرمین (تزریق زیر جلدی، 15 یا 30 میلیگرم یک بار در هفته، یا 44 میلیگرم یک بار در هر 2 هفته) یا دارونما (یک بار در هفته یا یک بار در هر 2 هفته) تقسیم شدند. نقاط پایانی اولیه شامل بهبود فیبروز در مرحله 1 یا بیشتر و عدم پیشرفت NASH بود. NASH بدون پیشرفت فیبروتیک برطرف شد. این مطالعه همچنین ارزیابی ایمنی را انجام داد.
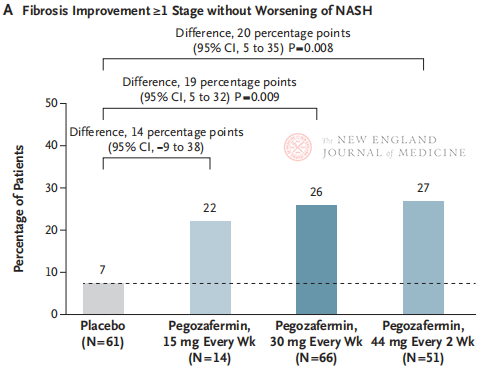
پس از ۲۴ هفته درمان، نسبت بیمارانی که بهبود فیبروز در مرحله ۱ یا بیشتر داشتند و NASH آنها بدتر نشد، و نسبت بیمارانی که NASH آنها پسرفت کرد و فیبروز آنها بدتر نشد، در سه گروه دریافت کننده دوز پگوزافرمین به طور قابل توجهی بیشتر از گروه دارونما بود، و تفاوتهای معناداری در بیمارانی که با ۴۴ میلیگرم هر دو هفته یک بار یا ۳۰ میلیگرم هر هفته یک بار درمان شدند، بیشتر بود. از نظر ایمنی، پگوزافرمین مشابه دارونما بود. شایعترین عوارض جانبی مرتبط با درمان پگوزافرمین، تهوع، اسهال و قرمزی در محل تزریق بود. در این کارآزمایی فاز ۲b، نتایج اولیه نشان میدهد که درمان با پگوزافرمین فیبروز کبد را بهبود میبخشد.
پگوزافرمین که در این مطالعه مورد استفاده قرار گرفت، یک آنالوگ گلیکوله شده طولانی اثر از فاکتور رشد فیبروبلاست انسانی ۲۱ (FGF21) است. FGF21 یک هورمون متابولیک درونزا است که توسط کبد ترشح میشود و در تنظیم متابولیسم لیپید و گلوکز نقش دارد. مطالعات قبلی نشان دادهاند که FGF21 با افزایش حساسیت به انسولین در کبد، تحریک اکسیداسیون اسیدهای چرب و مهار لیپوژنز، اثرات درمانی بر روی بیماران NASH دارد. با این حال، نیمه عمر کوتاه FGF21 طبیعی (حدود ۲ ساعت) استفاده از آن را در درمان بالینی NASH محدود میکند. پگوزافرمین از فناوری پگیلاسیون گلیکوزیله برای افزایش نیمه عمر FGF21 طبیعی و بهینهسازی فعالیت بیولوژیکی آن استفاده میکند.
علاوه بر نتایج مثبت در این کارآزمایی بالینی فاز 2b، مطالعه اخیر دیگری که در Nature Medicine (ENTRIGUE) منتشر شده است، نشان داد که پگوزافرمین همچنین تری گلیسیرید، کلسترول غیر HDL، آپولیپوپروتئین B و استئاتوز کبدی را در بیماران مبتلا به هیپرتری گلیسیریدمی شدید به طور قابل توجهی کاهش میدهد، که ممکن است تأثیر مثبتی بر کاهش خطر حوادث قلبی عروقی در بیماران مبتلا به NASH داشته باشد.
این مطالعات نشان میدهد که پگوزافرمین، به عنوان یک هورمون متابولیک درونزا، میتواند مزایای متابولیکی متعددی را برای بیماران مبتلا به NASH فراهم کند، به خصوص به این دلیل که NASH ممکن است در آینده به بیماری کبد چرب مرتبط با متابولیسم تغییر نام دهد. این نتایج، آن را به یک داروی بالقوه بسیار مهم برای درمان NASH تبدیل میکند. در عین حال، این نتایج مثبت مطالعه، پگوزافرمین را در کارآزماییهای بالینی فاز 3 پشتیبانی میکند.
اگرچه هر دو درمان با پگوزافرمین با دوز ۴۴ میلیگرم دو هفتهای یا ۳۰ میلیگرم هفتگی به نقطه پایانی اولیه بافتشناسی کارآزمایی دست یافتند، اما مدت درمان در این مطالعه تنها ۲۴ هفته بود و میزان انطباق با درمان در گروه دارونما تنها ۷٪ بود که به طور قابل توجهی کمتر از نتایج مطالعات بالینی قبلی که ۴۸ هفته به طول انجامید، بود. آیا تفاوتها و امنیت یکسان است؟ با توجه به ناهمگونی NASH، در آینده به کارآزماییهای بالینی بزرگتر، چند مرکزی و بینالمللی نیاز است تا جمعیتهای بیشتری از بیماران را در بر بگیرد و مدت درمان را افزایش دهد تا اثربخشی و ایمنی دارو بهتر ارزیابی شود.
زمان ارسال: ۱۶ سپتامبر ۲۰۲۳